Структура соли
Структура соли
Галит является одним из наиболее легко растворимых в воде минералов: в ста миллилитрах холодной воды растворяется тридцать шесть граммов. Жизнь зародилась в океане, а для жизни необходима соль, так что если бы соль не обладала такой высокой растворимостью, жизнь на Земле была бы совсем другой.
В 1887 году шведский химик Сванте Август Аррениус предположил, что свойства соли и ее растворов можно объяснить наличием в этом веществе противоположно заряженных ионов. Более ста лет химики были заинтригованы удивительным свойством растворов соли — их способностью проводить электрический ток. Дождевая вода не проводит ток, а вот растворы хлорида натрия и других солей являются прекрасными проводниками. Гипотеза Аррениуса объясняла это наблюдение. Его эксперименты показали, что при повышении концентрации соли в растворе увеличивается концентрация заряженных частиц (ионов), необходимых для проведения электрического тока.
Предложенная Аррениусом концепция ионного строения веществ также позволяла объяснить, почему кислоты, имеющие разную структуру, обладают похожими свойствами. В водных растворах всех кислот образуются ионы водорода (H+), которые и отвечают за кислый вкус и химическую активность кислот. Сначала идеи Аррениуса не были приняты многими его современниками, однако он настойчиво разъяснял свою теорию. В итоге критики приняли его сторону, и в 1901 году Аррениус получил Нобелевскую премию по химии за свою теорию электролитической диссоциации.
К тому времени появились теоретические и практические доказательства существования ионов. Английский физик Джозеф Джон Томпсон в 1897 году показал, что все атомы содержат электроны — отрицательно заряженные частицы, объясняющие электрическую проводимость веществ (впервые об этом заявил Майкл Фарадей в 1833 году). Если атом теряет один или несколько электронов, он превращается в положительно заряженный ион. Если другой атом приобретает один или несколько электронов, он превращается в отрицательно заряженный ион.
Твердый хлорид натрия представляет собой регулярную решетку из двух типов ионов — положительно заряженных ионов натрия и отрицательно заряженных ионов хлора, которые удерживаются вместе за счет сил притяжения между отрицательными и положительными зарядами.
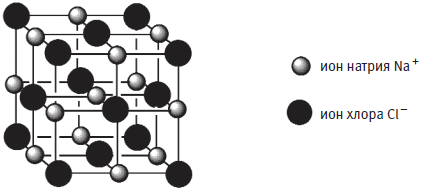
Трехмерная структура твердого хлорида натрия. Линии, соединяющие ионы, вымышленные: они изображены только чтобы показать кубическое строение решетки соли.
Вода не состоит из ионов, но ее молекулы имеют так называемый частичный заряд: на атомах водорода сосредоточен слабый положительный заряд, а на атоме кислорода — слабый отрицательный заряд. Это и позволяет хлориду натрия растворяться в воде. Хотя сила притяжения между отрицательно заряженным ионом хлора и положительно заряженным атомом водорода в молекуле воды (а также между положительно заряженным ионом натрия и отрицательно заряженным атомом кислорода в молекуле воды) примерно такая же, как между самими ионами хлора и натрия, решающим фактором в высокой растворимости соли является стремление ионов к случайному распределению. Если соли плохо растворяются в воде, это означает, что притяжение между составляющими их ионами сильнее, чем притяжение между ионами и водой.
Изобразим молекулу воды с имеющимися на ней частичными зарядами:
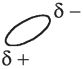
Здесь ? — обозначает слабый (частичный) отрицательный заряд на атоме кислорода, а ?+ — слабый (частичный) положительный заряд на атомах водорода. Теперь мы можем схематично изобразить отрицательно заряженный ион хлора, который в водном растворе окружен молекулами воды, повернутыми к нему соответствующим концом:
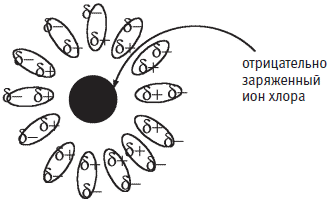
Положительно заряженный ион натрия в воде окружен молекулами воды, повернутыми к нему своим отрицательно заряженным концом.

Именно хорошая растворимость хлорида натрия делает его ценным консервирующим агентом. Соль сохраняет мясо и рыбу, отбирая из них воду. При низком содержании воды и высоком содержании соли бактерии, вызывающие порчу продуктов, просто не могут жить. С целью предотвращения порчи в продукты добавляют гораздо больше соли, чем требуется для усиления вкуса. В тех регионах, где пищевым источником соли являлось исключительно мясо, для сохранения мяса добавляли больше соли. В других традиционных методах сохранения пищевых продуктов, таких как высушивание и копчение, тоже используют соль. Перед сушкой и копчением рыбу или мясо вымачивают в солевом растворе. Жители тех мест, где не было своей соли, вынуждены были ее покупать.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
17.28. Письмо о соли из Бонна
17.28. Письмо о соли из Бонна «Оригинальным средством воспользовалась при проведении переписи населения столица ФРГ Бонн, чтобы выяснить местонахождение граждан, не охваченных переписью. В сентябре (летнем месяце!) 4170 гражданам были разосланы письма с призывом не сыпать
Потребность организма в соли
Потребность организма в соли О том, что соль необходима для жизни, люди знали уже в те древнейшие времена, когда еще не было необходимости в сохранении пищевых продуктов. Ионы соли играют в организме очень важную роль, поддерживая электролитный баланс между клетками и
Структура
Структура Какие организации входят в Разведывательное сообщество США? Согласно закону № 12333 от 4 декабря 1981 г. «О разведывательной деятельности Соединённых Штатов» (часть 3, параграф 4, пункт «f»), их список выглядел следующим образом:«1) Центральное разведывательное
Структура ЦРУ
Структура ЦРУ В отличие от АНБ, стремящегося к максимальной скрытности и болезненно реагирующего на любые публикации о себе, руководство ЦРУ, напротив, придаёт большое значение информированию общественности о своей деятельности, полагая, что разумная доля гласности
Структура ФБР
Структура ФБР Имеющиеся открытые источники позволяют достаточно точно воссоздать внутреннее устройство этой неутомимо стоящей на страже американской демократии организации.Директор ФБР назначается на свой пост президентом США, при этом его кандидатура утверждается
Структура АНБ
Структура АНБ По своему статусу АНБ является «особым агентством в составе Министерства обороны». Возглавляющий его директор должен быть военнослужащим, ранее работавшим в разведке и имеющим звание трёхзвёздного генерала (то есть генерал-лейтенанта) или вице-адмирала.
Структура СС США
Структура СС США Вплоть до недавнего времени Секретная служба США входила в состав Министерства финансов, а возглавляющий её начальник (Chief) (с 1965 г. — директор) был подчинён министру финансов. Однако с 1 марта 2003 г. она находится в составе Министерства внутренней
Дело комнатной бабки, укравшей горсть соли
Дело комнатной бабки, укравшей горсть соли 1671 г. августа в 13 день по указу (в. государя царя) и в. к. Алексея Мих. (титул) государыни царицы и в. к. Наталии Кириловны комнатная бабка Марфа Тимофеева роспрашивана накрепко, а сказала: в нынешнем де во 179 г. августа 11 дня, пришла
О РЫБЕ И СОЛИ
О РЫБЕ И СОЛИ Описание портов и эмпорий дает нам картину в первую очередь торговых отношений этруссков с соседями. Однако в этих портах осуществлялась и хозяйственная деятельность — лов рыбы. Живописные фрески гробницы в Тарквиниях «Охота и рыбалка» сохранили для нас
Структура
Структура После существенных потрясениях в разведывательных службах Израиля, которые произошли в связи с «делом Лавона», сформировалась новая структура «Моссада». В конце пятидесятых и в шестидесятые этот «институт» разделялся на восемь департаментов. Наиболее
Структура ВЧК
Структура ВЧК Сам Дзержинский разработал основные положения деятельности нового органа политической безопасности сначала Советской России, а затем и СССР, он же был главным разработчиком и внутренней структуры ВЧК. Уже в начале 1918 года внутри ЧК появились отделы борьбы
Структура
Структура Структуру ассирийской армии, как и всякой прочей, можно рассматривать с разных позиций. С точки зрения административной военная машина Древней Ассирии состояла из двух основных компонентов: «царского войска» цаб шарри (s?b ?arri) и «царского полка» кицир шаррути
IV. Дорога к Новому-Усолью. — История соляных промыслов. — Производство соли
IV. Дорога к Новому-Усолью. — История соляных промыслов. — Производство соли Из Романова дорога идет лесом. Мы переехали чрез речки Пекурку, Зюзву, Волим, Песьянку, потом поднялись на крутую гору. Опять лес, опять дикая природа. На дороге нам попалась деревня Балахонцова,
Зачем бунтовать из-за соли?
Зачем бунтовать из-за соли? В 1620-х гг. в России (без Сибири) был 181 город (среди них 42 пограничных крепости), а к 1650 г. — 226 (правда, около трети из них — крепости). Количество посадских дворов оценивается в 100 тысяч, но в городах жило и много неучтенного «гулящего люда», то есть